¡Hola, amigos de Dolortornu.com.ar! Hoy vamos a charlar sobre un tema que quizás hayan escuchado nombrar bastante: la toxina botulínica. Pero no se asusten, ¡vamos a desmitificarla y conocerla como si estuviéramos tomando un café juntos!
¿Qué es la Toxina Botulínica?
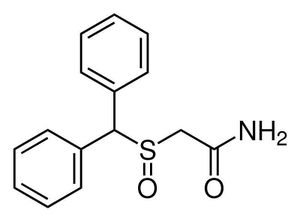
La toxina botulínica, comúnmente conocida por su uso en tratamientos estéticos, es en realidad una sustancia bastante interesante. Aunque muchos la asocien solo con la reducción de arrugas, ¡hay mucho más en esta historia!
Usos que Quizás no Conocías
Aparte de hacernos lucir más jóvenes y relajados, la toxina botulínica tiene otros usos sorprendentes. ¿Sabías que se utiliza en tratamientos médicos como para la hiperhidrosis (sudoración excesiva) y hasta para algunas condiciones neurológicas? Sí, es mucho más versátil de lo que pensamos.
Un Proceso Sencillo y Seguro
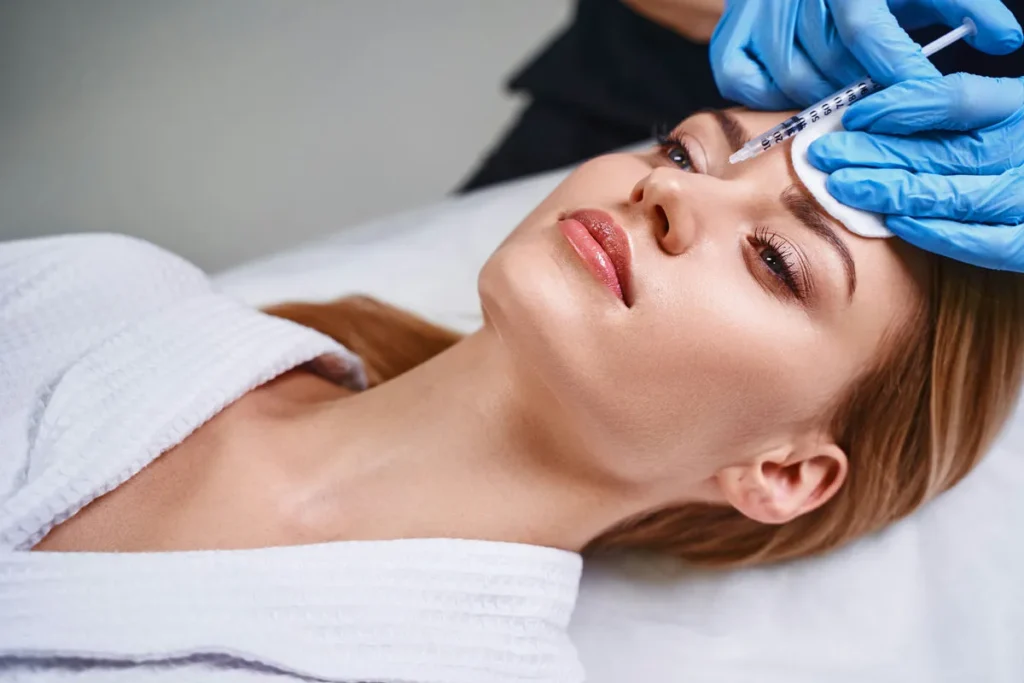
Cuando se trata de su aplicación en estética, el proceso es bastante sencillo. Se inyecta en áreas específicas del rostro, y su principal tarea es relajar los músculos que forman arrugas. Lo importante es siempre acudir a un profesional calificado, para que todo salga como esperamos.
¿Duele? ¿Es Seguro?
Estas son las preguntas del millón. La mayoría de las personas sienten un pequeño pinchazo, pero nada que no se pueda tolerar. Y en cuanto a la seguridad, cuando lo maneja un profesional experimentado, es un tratamiento bastante seguro.
La Importancia de la Moderación
Como en todo, la moderación es clave. Los resultados pueden ser muy naturales y satisfactorios si no se exagera en su uso. La idea es realzar nuestra belleza, no transformarnos en alguien irreconocible.
Conclusión: Un Tema Fascinante
En Dolortornu.com.ar, nos encanta explorar estos temas que generan curiosidad. La toxina botulínica, más allá de los mitos y miedos, es una herramienta fascinante tanto en el mundo de la medicina como en el de la estética. Y lo mejor de todo, es que podemos hablar de ella como amigos, aprendiendo y descubriendo juntos. ¡Hasta la próxima charla!